Série d'exercices : Classification quantitative des couples oxydant - réducteur ion métallique/métal - 1er s
Exercice 1
Exercice 2
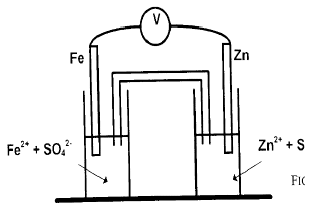
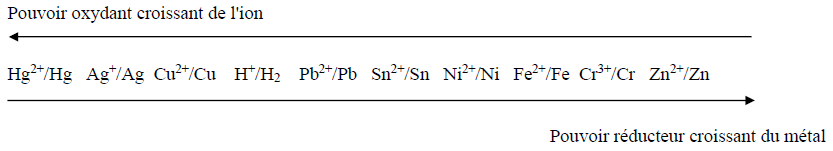
Exercice 3
Exercice 4
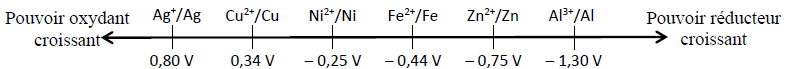
Document : La Statue de la Liberté en péril : la corrosion
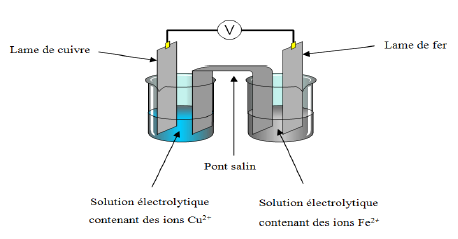
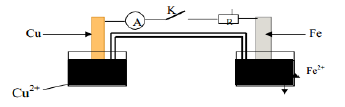
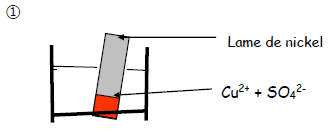
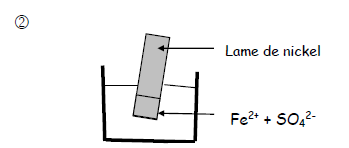
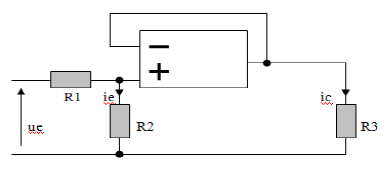
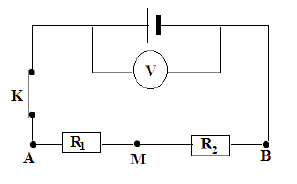
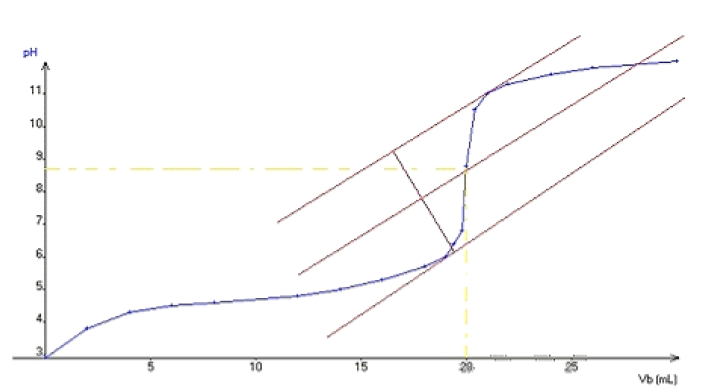
Exercice 5
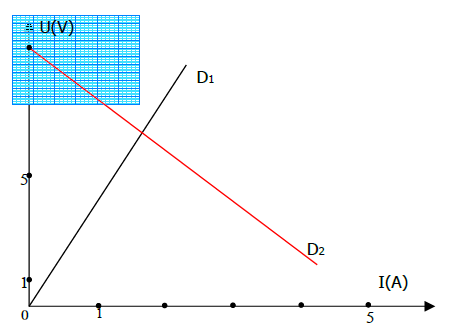
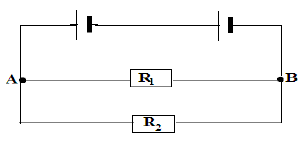
Exercice 6

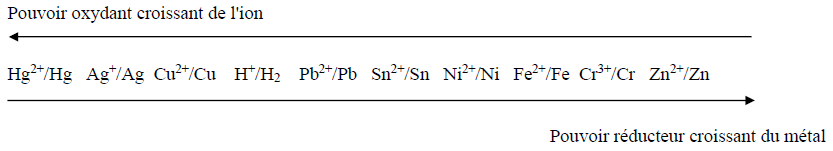
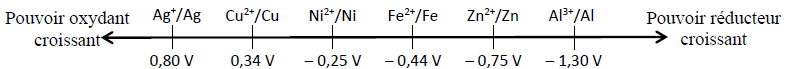


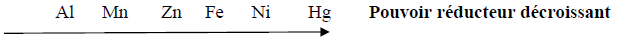
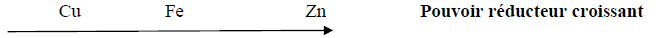
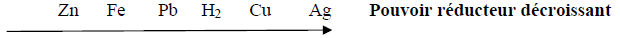
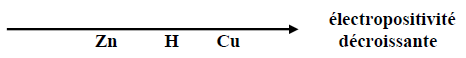

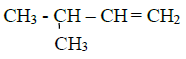
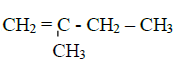
Tous les objets qui nous entourent (êtres vivants, végétaux, minéraux …..) constituent la matière
Les roches, les arbres, l’air…..etc., ont des exemples de matières
I. Les états physiques de la matière et changements d’états
1. Etats physiques de la matière La matière se présente dans la nature sous trois états différents : l’état solide, l'état liquide et l’état gazeux
1.1. L'état solide A l'état solide, un corps possède une forme et un volume propres Les solides sont incompressibles Moyennant un effort, on peut changer la forme d’un solide, mais il est pratiquement impossible de faire varier son volume Certains solides sont élastiques, mais chaque solide à sa limite d’élasticité Exemples : cahier, bois, fer, charbon….
1.2. L’état liquide Les liquides n’ont pas de forme propre, mais leur volume est invariable ; ils sont fluides et incompressibles
Exemples : l’eau, pétrole, l’essence, le lait……
Remarque Les solides en poudre, divisés ou pulvérisés s’écoulent comme les liquides, mais leur surface libre n’est ni plane, ni horizontale comme les liquide
1.3. L’état gazeux
Les gaz n’ont pas de forme propre, ni de volume propre. Ils sont compressibles, expansibles et élastiques. Ils sont fluides
Exemples : l’air, le dioxyde de carbone, le dioxygéne….
Remarque : Les solides sont caractérisés par un état ordonné et compact. L’état liquide est désordonné .L'état physique des gaz est désordonné et diffus
2. Les changements d’état physique
2.1. Définition Le passage d’un état physique à un autre état physique est appelé changement d’état
2.2. Digramme de changement d'état
Un changement d’état physique s’effectue toujours à une température constante sous une pression donnée
3. Les transformations de la matière
3.1. Phénomène physique Un phénomène physique est une transformation au cours de laquelle la nature de la matière n’est pas altérée (dénaturée ou détruite)
Exemples : la fusion de la glace ; la dilatation des métaux ; la rosée….
3.2. Phénomène chimique
Un phénomène chimique est une transformation au cours de laquelle la nature de la matière est altérée (dénaturée ou détruite) Exemples : Action de l’eau de Javel sur une tache ; la décomposition de la craie par un acide ; feuille de papier brulée …. II. Les mélanges
1. Définition Un mélange est un ensemble de deux ou plusieurs constituants Il peut être solide, liquide ou gaz
2. Mélange hétérogène Un mélange hétérogène est un mélange dans lequel on peut distinguer à l’ œil nu ses différents constituants Exemples : $eau_{+} huile ; eau_{+} terre$ ; boissons gazeuses
3. Mélange homogène Un mélange homogène est un mélange dans lequel on ne peut pas distinguer à l’ œil nu ses différents constituants Exemples : lait ; sirop ; thé
Z***c
4. Méthodes de séparation des constituants d’un mélange
Il existe de nombreuses méthodes variables de séparation selon la nature du mélange et la nature
des constituants qui le constituent.
Parmi ces méthodes, on citer :
4.1. La décantation
La décantation est une de séparation qui consiste à laisser le mélange au repos pour que les particules solides lourdes se déposent au fond du récipient.
En transvasant, on peut séparer le liquide de ces particules. Le produit de la décantation est appelé décantat
Exemples de décantation
-Décantation d’un mélange solide-liquide : jus d’orange
-Décantation d’un mélange liquide-liquide :
4.2. La filtration La filtration est une méthode de séparation qui consiste à faire passer le mélange liquide à travers un filtre .
Le produit de la filtration est appelé filtrat
4.3. La distillation
La distillation est une méthode de séparation basée sur la différence de température d’ébullition.
Elle consiste à vaporiser partiellement un mélange liquide homogène et à condenser
les vapeurs formées pour les séparer Le produit de la distillation est appelé distillat
Exemple : distillation de l’eau sucrée
Remarque :
Pour séparer les différents constituants de l’air, on le liquéfie en le comprimant. On procède alors à la
distillation de ce liquide Au début de l’ébullition (température de liquéfaction du diazote liquide $(–196°C)$), il se dégage du diazote, puis le dioxygène lorsque la température atteint$ -183^{0}C $(température de liquéfaction du dioxygène) L’air est donc un mélange dont l’expérience montre qu’il est constitué de $78%$ de diazote ($4/5$ en volume) , de $21%$ de dioxygène ($1/5$ en volume) et $1%$ d’autres gaz (gaz rares, dioxyde de carbone et de la vapeur d’eau)
4.4. Quelques autres méthodes de séparation
4.4.1.congélation C’est une méthode de séparation basée sur la différence de cristallisation (température à laquelle un corps se congèle).
Le corps dont sa température d’ébullition est plus grande est récupéré le premier sous formes de cristaux
4.4.2. Le tamisage Si les grains de différents solides ont des dimensions différentes, le passage au tamis permet de les séparer
4.4.3. La flottation On mouille le mélange. Selon le liquide choisi, certaines particules flottent
4.4.4. Le triage magnétique Si un des constituants du mélange contient du fer, les particules de ce constituant sont attirées par l’aimant
III. Corps purs
1. Définition Un corps pur est un corps qu’on ne peut pas fractionner par une méthode quelconque de séparation
2. Critères de pureté d’un corps pur Tout corps pur est défini par les constantes physiques parmi lesquelles on citer :
-la masse volumique -les points de changement d’état : température de fusion, d’ébullition, de solidification etc…..
Exemple : Valeurs de quelques constantes physiques de l’eau pure. -masse volumique : $1kg/L$
-température de solidification ou de fusion : $t=0^{0}C$
-température d’ébullition ou de liquéfaction : $t= 100^{0}C$
3. Corps purs simples et corps purs composés
3.1. Analyse de l’eau
3.1.1. Définition Analyser un corps revient à chercher ses constituants par une méthode appropriée
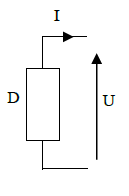
3.1.2. L’électrolyse de l’eau
Mettons de l’eau additionnée de quelques gouttes d’acide dans le voltamètre (ou cuve à l’électrolyse) et fermons l’interrupteur
On constate que le courant circule et des dégagements gazeux au niveau des tubes A l’anode (signe+), le gaz recueilli rallume une buchette presque éteinte. Ce gaz est le dioxygène
A la cathode (signe-), le gaz recueilli a volume deux fois grand et produit une légère détonation en présence d’une allumette enflammée. Ce gaz est le dihydrogène
Conclusion :
-L’eau est décomposé par le courant électrique en dioxygène et en dihydrogène
-Le volume de dihydrogène est le double du volume de dioxygène : dihydrogène dioxygène $V_{dihydrogène}= 2V_{dioxygène} $
-La masse totale des gaz (dihydrogène et dioxygène) est égale à la d’eau disparue : $m_{e}=m_{H}+ m_{o}
eau⎯→ dioxygène + dihydrogène
18g 16g 2g $
Les masses de dihydrogène et de dioxygène sont proportionnelles à la masse d’eau disparue
$\frac{m_{H}}{m_{E}} =\frac{2g}{18g} \Longrightarrow{ m_{H}} = \frac{1}{9}m_{E}
\frac{m_{o}}{m_{E}} =\frac{16g}{18g} \Longrightarrow{m_{o} }= \frac{8}{9}m_{E}$
-Un corps pur qui peut décomposer en deux ou plusieurs corps purs est un corps pur composé
Exemple : l’eau
-Un corps pur qui ne peut être décomposé en d’autres corps purs est un corps simple
Exemples : le dioxygène et le dihydrogène
3.2. Synthèse de l’eau
3.2.1. Définition
La synthèse de l’eau est la formation de l’eau à partir du mélange du dihydrogène et du dioxygène.
3.2.2. Synthèse eudiométrique
On déclenche des étincelles électriques au niveau des électrodes pour amorcer le processus de synthèse
- La pression des gaz baisse, le niveau de mercure qui va remonter lorsque les deux gaz réagissent en formant une buée (eau) sur la paroi interne du tube eudiométrique.
$dioxygène + dihydrogène eau ⎯→
16g 2g 18g$
La masse d’eau produite est proportionnelle à la masse de dihydrogène ou à la masse de dioxygène
$\frac{m_{E}}{m_{H}} =\frac{18g}{2g} \Longrightarrow{ m_{E} =9m_{E}}
\frac{m_{E}}{m_{O}} =\frac{18g}{16g} \Longrightarrow{m_{E}} = \frac{9}{8}m_{O}$
ELEMENTS, ATOMES, CLASSIFICATION PERIODIQUE DES ELEMENTS
I. Eléments
1. Mise en évidence de l’élément carbone
1.1. Pyrolyse du bois
La pyrolyse du bois donne du charbon de bois
1.2. Pyrolyse du sucre La pyrolyse du sucre donne un solide noir appelé charbon de sucre
1.3. Conclusion Le charbon de bois (produit de la pyrolyse du bois), le solide noir (résidu de la pyrolyse du sucre) contiennent un constituant commun : le carbone
2. Définition de l’élément chimique Un élément chimique est un constituant commun à tous les corps qui le contiennent
Remarque
-Les corps purs simples sont formés d’un seul élément
Exemples : le dihydrogène est formé de l’élément hydrogène ;
le dioxygène est formé de l'élément oxygène
-Les corps purs composés sont formés de plusieurs éléments
Exemples : l’oxyde de dihydrogène (eau) est formé de l’élément oxygène et l'élément hydrogène ;
le dioxyde de carbone (gaz carbonique) est formé de l’élément oxygène et de l'élément carbone
3. Notation de l'élément chimique
Pour faciliter l’étude de la chimie, les éléments sont représentés par des
symboles Généralement, on utilise la première lettre majuscule du nom (français, latin, grec, étranger….)
Lorsque plusieurs éléments commencent par la même lettre, on ajoute une seconde lettre minuscule pour les
différencier
Symboles de quelques éléments chimiques
H C F Na N O F Ca
| Elément | Hydrogène | Carbone | Fer | Sodium | Azote | Oxygène | Fluor | Calcium |
| Symbole | H | C | F | Na | N | O | F | Ca |
II. Atomes
La matière est faite à partir des particules extrêmement petites appelées atomes.
Les propriétés chimiques des corps purs peuvent être interprétées à partir d’un modèle unique d’atome
1. Dimension de l’atome L’atome est représenté par une sphère infiniment petite .
Le diamètre de l’atome est de l’ordre de l’Angstrom (symbole ; A°) ; 1A°=10-15m
2. Les constituants de l’atome
2.1. Le modèle atomique L’atome peut être modélisé par une structure présentant un noyau autour duquel
existe une zone dans laquelle on peut trouver les électrons. Cette partie
de l’atome est appelée nuage électronique
2.2. Les caractéristiques des constituants de l’atome
Les expériences montrent que l’atome est constitué de protons, de neutrons et d’électrons
| Particule | Masse | Charge |
| Proton | $m_{P}=1.672.10^{-26}kg$ | $q_{p}=1.6.10^{-19}C$ |
| Neutron | $m_{n}=1.674.10^{-26}kg$ | $q_{n}=0C$ |
| Electron | $m_{e}=9.1.10^{-31}kg$ | $q_{e}=-1.6.10^{-19}C$ |
Remarque :
-La masse $m_{P}=m_{n}=1836m_{e}$. La masse des électrons est $1836$ fois plus petite que celle du proton ; donc négligeable par rapport à celle-ci
-Les charges des protons et des électrons sont identiques et ces particules sont en même nombre dans l’atome ; l'atome est donc électriquement neutre
3. Structure de l'atome
3.1. Le noyau Le noyau est constitué de deux types de particules : les neutrons et les protons .
Ces deux types particules constituants du noyau sont appelés nucléons Chaque atome est caractérisé par :
-le nombre de protons $Z$ qu’il renferme .Ce nombre est aussi appelé numéro atomique ou nombre de charge
-le nombre de nucléons $A$ qu’il renferme .Ce nombre est aussi appelé nombre de masse : $A=Z+N
N$ étant le nombre de neutrons
On symbolise le noyau des atomes par :
$A = Z + N =$ nombre de masse d'un noyau, c'est le nombre de nucléons (protons + neutrons) qu'il contient.
$Z =$ numéro atomique d'un noyau, c'est le nombre de protons qu'il contient.
Exemples : $^{12}_{6}C;^{16}_{8}O.^{1}_{1}H;^{14}_{7}N$
Exemples : $^{12}_{6}C$
Remarque :
Des atomes sont dits isotopes lorsqu’ils renferment le même nombre de protons mais de nombre de
nucléons (ou nombre de neutrons) différents Exemples :$^{12}_{6}C , ^{13}_{6}C$ et $^{14}_{6}C;^{1}_{1}H,^{2}_{1}H$ et$ ^{3}_{1}H$
3.2. Le nuage électronique
3.2.1. Notion du niveau d’énergie
Les électrons d’un atome sont répartis en couche de niveau d’énergie différent. Pour arracher les électrons d’une même couche, il faut lui fournir la même énergie.
On dit que les électrons d’une même couche ont le même niveau d’énergie
Les couches sont désignées par des lettres $K, L, M, N, O, P, Q……$.
A chaque couche correspond un nombre entier positif$ n$
| n | $1$ | $2$ | $3$ | $4$ | $5$ | $6$ | $7$ |
| Lettre | K | L | M | N | O | P | Q |
3.2.2. Règle de remplissage des couches
La répartition des électrons d’un atome sur les différentes couches ou niveaux d’énergie obéit à deux règles :
-la première règle ; le nombre maximal d’électrons pouvant à une couche est :$ N=2n^{2}$
Exemples :
Couche $K : N=2\times{1^{2}}\Longrightarrow{N=2}électrons $
Couche $L : N=2\times{2^{2}}\Longrightarrow{N=8}électrons$
Couche$ M : N=2\times{3^{2}}\Longrightarrow{N=18}électrons$
-la deuxième règle ; on remplit successivement les couches dans l’ordre $K, L, M, N…$..
Une couche ne commence à se remplir que si la précédente est saturée
3.2.3. La configuration électronique
Pour donner la structure électronique ou la .configuration électronique, on représente tous les électrons par des points (.) dans des cases portant autant de places disponibles dans une couche déterminée Nature
3.2.3. La formule électronique
On écrit la lettre qui correspond à chaque couche et on indique en exposant en haut à droite le nombre
d’électrons par couche
Exemples : $H (Z=1) :K^{1} ; He (Z=2) : K^{2} ; Li (Z=3) :K^{2} L^{1}; C (Z=6) :K^{2} L^{4}; O (Z=8) :K^{2} L^{6} Al (Z=13) :K^{2} L^{8}M^{3}$
3.3. Structure de Lewis d’un atome La représentation de Lewis permet de mettre en évidence les électrons de la couche externe ou couche
périphérique. Les électrons célibataires sont représentés par des points (.) ; les doublets sont représentés par
un tiret (-) placé autour de l’élément considéré Exemples
| Symbole | H | C | N | O | P | CI | Na | Ne |

3.4. Valence d’un atome
Le nombre d’électrons célibataires que possède l’élément est la valence Symbole H C N O P Cl Représentation de Lewis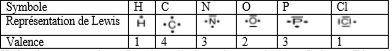
4. Masse de l’atome
La masse M de l’atome est la relation suivante :
$M=m_{mnoyau}+m_{éléctrons}\Longrightarrow{M=Zm_{p}+Nm_{n} +Zm_{e}}$
Si$ m_{p} =m_{n} \Longrightarrow{M=Zm_{p}+Nm_{p} +Zm_{e}}\Longrightarrow= (Z+N) m_{p} +Zm_{e}\Longrightarrow{ M=Am_{p}} +Zm_{e}$
Si on néglige la masse des électrons\Longrightarrow{ M=Am_{p}}$
5. Structure lacunaire de l’atome
La matière de l’atome est essentiellement concentrée dans son noyau. Les électrons tournent autour du noyau.
Les distances séparant le noyau des électrons sont très grandes. Ainsi, la plus grandes partie (volume) est constituée de vide.
On dit que l’atome a une structure lacunaire
III. Classification périodique des éléments chimiques
1. Principe de la classification
-Les éléments chimiques sont classés par numéro atomique $Z$ croissant ;
-Les éléments dont les atomes ont le même nombre d’électrons sur leur couche externe sont disposés dans une même colonne verticale et constituent un groupe ou une famille
-Chaque ligne ou période correspond au remplissage d’une couche électronique
2. Tableau simplifié
Le tableau simplifié comporte trois lignes ou périodes et huit colonnes ou groupe GROUPES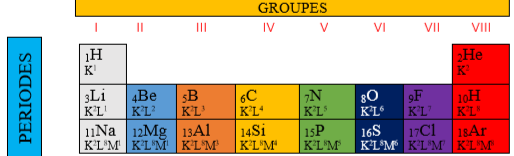
3. Intérêt de la classification périodique
Les atomes des éléments de même colonne ont le même nombre d’électrons périphériques. Ils ont des
propriétés chimiques semblables et forment un groupe ou famille Considérons quelques exemples :
3.1. La famille des métaux alcalins.
- A l’exception de l’hydrogène, les éléments de la première colonne constituent le groupe des alcalins.
- Ils ont la même structure électronique externe. Il possède $1$ électron sur la couche électronique externe.
$Li $(Lithium) ;$ Na$ (Sodium) ; $K$ (Potassium)
- Les corps simples correspondant à ces éléments sont appelés les métaux alcalins.
- Ce sont des corps mous, légers à l’éclat métallique, très réactifs chimiquement.
- Ils sont oxydés par le dioxygène de l’air.
Il faut les conserver dans le pétrole, à l’abri de l’air.
3.2. La famille des Halogènes.
-Les éléments de la 7ième colonne constituent la famille des Halogènes.
Ces éléments possèdent la même structure électronique externe à $7$ électrons. $F$ (Fluor) ; $Cl$ (Chlore) ; $Br$ (brome) ; $I$ (iode
-Ils existent sous la forme de molécules diatomiques :
-Le difluor, le dichlore (gaz jaune-vert), le dibrome (liquide jaune-orangé), le diiode (solide violet foncé).
3.3. La famille des gaz nobles.
-Ce sont les éléments de la dernière colonne.
- L’Hélium mis à part, ils possèdent une structure externe à huit électrons appelée octet d’électrons. $He$ (Hélium); $Ne$ (Néon) ; $Ar$ (Argon)
-Ils possèdent une grande stabilité chimique. Ce sont des gaz monoatomiques, on les appelle les gaz rares ou gaz inertes
4. Les ions monoatomiques Certains atomes peuvent perdre ou gagner des électrons et deviennent des ions simples 4.1. Les cations Un cation ou ion positif provient d’un atome qui a perdu un ou plusieurs électron(s)
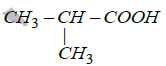 : acide $2-$methylpropanoique
: acide $2-$methylpropanoique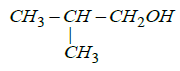 : $2-\text{methylpropan}-1-\text{ol}$
: $2-\text{methylpropan}-1-\text{ol}$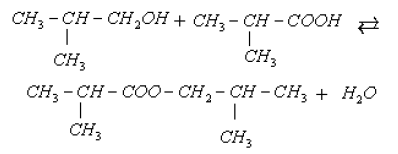
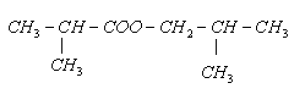 $2-\text{méthylpropate}-2-\text{méthylpropyle}$
$2-\text{méthylpropate}-2-\text{méthylpropyle}$