Solutions des exercices : Mélanges et corps purs - 4e
Classe:
Quatrième
Exercice 1
Encadrons la lettre correspondant à la bonne réponse.
Un mélange dans lequel on peut distinguer les différents constituants à l'œil nu est un mélange dit
a) Homogène
$\boxed{\text{b) hétérogène}}$
c) stable
Exercice 2
On dispose des mélanges suivants :
a) eau de mer ;
b) eau de ruissellement ;
c) eau minérale ;
d) jus de bissap ;
e) fer+soufre ;
f) huile + eau
Complétons le tableau ci-dessous en écrivant la lettre correspondant à chaque mélange dans la colonne qui convient
$$\begin{array}{|c|c|} \hline \text{Mélange homogène}&\text{Mélange hétérogène}\\ \hline a\;,\ c\;,\ d&b\;,\ e\;,\ f\\ \hline \end{array}$$
Exercice 3
a) eau de mer ;
b) eau de ruissellement ;
c) eau minérale ;
d) jus de bissap ;
e) fer + soufre ;
f) huile + eau
Donnons pour chaque mélange la méthode de séparation appropriée
$$\begin{array}{|c|l|} \hline \text{Mélanges}&\text{Méthodes de séparations}\\ \hline a&\text{Décantation}\\ \hline b&\text{Filtration}\\ \hline c&\text{Distillation fractonnée}\\ \hline d&\text{Distillation fractonnée}\\ \hline e&\text{Triage magnétique}\\ \hline f&\text{Décantation}\\ \hline \end{array}$$
Choisissons la bonne réponse.
On peut séparer l'eau et le sucre par :
$\centerdot\ $ Décantation
$\centerdot\ $ Filtration
$\boxed{\centerdot\ \text{Distillation}}$
Exercice 4
Complétons le texte par les mots suivants :
filtration, potable, hétérogène, décantation, homogène.
Une ménagère a ramené de l'eau du fleuve.
Cette eau est un mélange hétérogène.
Elle la laisse au repos dans la bassine pendant une demi-heure, des substances étrangères se déposent au fond du récipient par décantation.
Elle verse l'eau dans un canari à travers un morceau à gaze. L'opération s'appelle la filtration.
Le filtrat est un mélange homogène.
Puis, elle y introduit quelques gouttes d'eau de javel pour rendre l'eau potable.
Exercice 5
La chambre de Samba a les dimensions suivantes :
$$h=3\;m\;;\ \ell=3.30\;m\;;\ L=3.5\;m$$
1) Calculons le volume d'air $V_{\text{air}}$ renfermant cette chambre.
La chambre de Samba étant de forme parallélépipédique alors, son volume $V$ est donné par :
$\begin{array}{rcl} V&=&L\times\ell\times h\\&=&3.5\times 3.30\times 3\\&=&34.65\;m^{3}\end{array}$
Comme le volume d'air renfermant cette chambre est équivalent à $V$ alors, on obtient :
$\boxed{V_{\text{air}}=34.65\;m^{3}}$
2) Calculons le volume de dioxygène disponible pour samba.
Dans la composition volumique de l'air nous distinguons :
$\centerdot\ \ 78\%$ de diazote
$\centerdot\ \ 21\%$ de dioxygène
$\centerdot\ \ 1\%$ de gaz rare
De ce fait, dans les $34.65\;m^{3}$ d'air renfermant la chambre de Samba, les $21\%$ sont du dioxygène.
Soit alors $V_{_{O_{2}}}$ ce volume de dioxygène.
On a : $V_{_{O_{2}}}=21\%V_{\text{air}}=\dfrac{21\times V_{\text{air}}}{100}$
A.N : $V_{_{O_{2}}}=21\%V_{\text{air}}=\dfrac{21\times 34.65}{100}=7.276$
D'où, $\boxed{V_{_{O_{2}}}=7.276\;m^{3}}$
Ainsi, Samba dispose de $7.276\;m^{3}$ de dioxygène.
3) Calculons le volume de diazote présent dans la chambre de Samba
Pour calculer ce volume $V_{_{N_{2}}}$ de diazote, on applique la même approche que dans la question 2).
Comme $V_{_{N_{2}}}=78\%V_{\text{air}}$ alors, $V_{_{N_{2}}}=\dfrac{78\times 34.65}{100}=27.027$
Soit : $\boxed{V_{_{N_{2}}}=27.027\;m^{3}}$
Exercice 6
A partir d'une eau boueuse et salée, on peut obtenir :
1) une eau limpide et salée, par filtration
2) une eau limpide non salée, par distillation
Exercice 7
Recopions et mettons une croix devant la bonne réponse.
1) On peut distinguer deux constituants d'un mélange
$\centerdot\ $ homogène
$\centerdot\ $ hétérogène $\ \boxed{\times}$
2) La filtration permet de séparer les constituants d'un mélange
$\centerdot\ $ homogène
$\centerdot\ $ hétérogène $\ \boxed{\times}$
3) Pour séparer les constituants d'un mélange homogène, on peut utiliser
$\centerdot\ $ une décantation
$\centerdot\ $ une distillation $\ \boxed{\times}$
4) Lorsqu'on laisse reposer un mélange, on réalise
$\centerdot\ $ une décantation $\ \boxed{\times}$
$\centerdot\ $ une distillation
Exercice 8
Modou explique à Fatou comment on fabrique du "Café Touba" : il lui indique les trois (3) étapes que comprend cette préparation.
$1^{ère}$ étape : mettre de l'eau dans une cafetière, porter l'eau à l'ébullition puis ajouter la poudre de "Café Touba" et attendre quelles minutes.
$2^{ème}$ étape : Faire passer le mélange obtenu à travers un tissu pour recueillir la partie liquide.
$3^{ème}$ étape : Ajouter du sucre à volonté et remuer à l'aide d'une cuillère.
Le "Café Touba" est prêt.
A la fin de la $1^{ère}$ étape, on obtient un mélange hétérogène parce qu'on peut distinguer, à l'œil nu, les particules solides du café dans le mélange.
La méthode de séparation utilisée dans la $2^{ème}$ étape est la filtration.
En chimie, le liquide obtenu après filtration est appelé : filtrat (qui est un mélange homogène)
Le filtrat n'est pas un corps pur.
A la fin de la $3^{ème}$ étape, on obtient un mélange homogène.
En effet, le filtrat est tout d'abord un mélange homogène et lorsque le sucre ajouté sera dissout dedans, on n'arrivera plus à distinguer, à l'œil nu, le sucre du filtrat.
Ce qui veut dire que le mélange final du "Café Touba" est un mélange homogène.
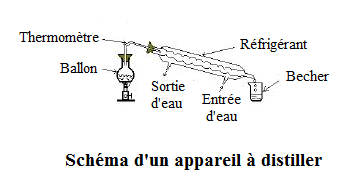
Exercice 9
Le schéma ci-dessous est celui de la distillation de l'eau salée.
1) Donnons les éléments manquants des annotations

2) Les changements d'états physiques qu'on y rencontre sont les suivants :
$-\ \ $ La vaporisation
Ce changement d'état se produit dans le ballon. L'eau se transforme en vapeur sous l'effet de l'augmentation de la température qui atteint $100^{\circ}C$
$-\ \ $ La liquéfaction
Ce changement d'état se déroule dans le réfrigérant. Les vapeurs d'eau se refroidissent et se condensent pour donner des gouttes d'eau.
3) Le corps obtenu, encore appelé distillat, est de l'eau ; un corps pur dont quelques-unes de ses propriétés sont :
$-\ \ $ Température d'ébullition $100^{\circ}C$
$-\ \ $ Température de fusion $0^{\circ}C$
$-\ \ $ Masse volumique $1000\;kg.m^{-3}$
Exercice 10
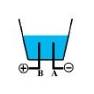
Le schéma ci dessous est un élément du montage expérimental de l'électrolyse de l'eau.

1) Précisons les noms respectifs des électrodes $A\ $ et $\ B.$
$\centerdot\ \ A\ $ est appelé Cathode : c'est l'électrode reliée à la borne négative de l'électrolyseur
$\centerdot\ \ B\ $ est appelé Anode : c'est l'électrode reliée à la borne positive de l'électrolyseur
2) Le gaz recueilli sur l'électrode $A$ est du dihydrogène et le gaz recueilli sur l'électrode $B$ est du dioxygène.
3) Pour mettre en évidence le dihydrogène, on approche une flamme à la cathode $A$, cela provoque alors une détonation. Ce qui montre la présence du dihydrogène.
Pour caractériser le dioxygène, on approche une bûchette en incandescence à l'anode $B.$ On constate alors que la bûchette se rallume. Ce qui met en évidence la présence du dioxygène.
Exercice 11
Faisons correspondre par une flèche chaque expression à la bonne réponse.
$$\begin{array}{|lcl|}\hline\text{Mélange}&\longrightarrow&\text{Association de deux ou de plusieurs}\\&&\text{substances}\\ \hline\text{Corps pur simple}&\longrightarrow&\text{Un corps qui ne peut pas se}\\&&\text{décomposer en d'autres corps}\\ \hline\text{Mélange homogène}&\longrightarrow&\text{Mélange dans lequel on ne peut pas}\\&&\text{distinguer ses différents constituants}\\ \hline\text{Corps pur composé}&\longrightarrow&\text{Un corps qui peut se décomposer en}\\&&\text{d'autres corps}\\ \hline\text{Mélange hétérogène}&\longrightarrow&\text{Association de plusieurs substances}\\ &&\text{qu'on peut distinguer}\\ \hline&&\text{Transformation qui ne modifie pas la}\\&&\text{nature des corps}\\ \hline\end{array}$$
Exercice 12
On dispose des mélanges suivants :
$\centerdot\ $ eau de mer
$\centerdot\ $ eau de ruissellement
$\centerdot\ $ eau minérale
$\centerdot\ $ jus de bissap
$\centerdot\ $ fer + souffre
$\centerdot\ $ huile + eau
Reproduisons le tableau ci-dessous et écrivons chaque mélange dans la colonne qui convient
$$\begin{array}{|l|l|}\hline\text{Mélange homogène}&\text{Mélange hétérogène}\\ \hline\text{eau de mer}&\text{eau de ruissellement}\\ \text{eau minérale}&\text{fer + souffre}\\ \text{jus de bissap}&\text{huile + eau}\\ \hline\end{array}$$
Exercice 13
Recopions et complétons les phrases ci-dessous avec les expressions suivantes :
filtration, mélange homogène, mélange hétérogène, décantation, distillation, de l'eau.
1) Dans un jus d'orange, il y a de la pulpe d'orange, du sucre, et de l'eau. La pulpe se dépose :
le jus d'orange constitue un mélange hétérogène.
Le jus filtré est un mélange homogène.
2) La boue se dépose au fond d'un lac par décantation.
L'eau qui pénètre dans le sol, traverse les couches de sable par filtration et devient limpide.
3) Lors d'une pénurie d'eau, une ménagère puise de l'eau dans un puits.
Cette eau est un mélange hétérogène.
Elle la laisse au repos dans un récipient pendant quelques minutes.
Des particules lourdes se déposent au fond du récipient par décantation.
Elle transvase l'eau dans une bassine à travers un morceau de gaze pour retenir les particules légères :
cette opération appelée filtration ; elle donne un mélange homogène.
Exercice 14
Proposons une méthode de séparation appropriée pour chacun des mélanges ci-dessous.
1) Fer et soufre : Triage magnétique
2) Eau et sucre : Distillation
3) Eau et huile : Décantation
4) Farine et grain de mil : Tamissage
5) Sable et eau : Filtration
Exercice 15
Recopions le tableau et indiquons la nature (corps pur, mélange, corps pur simple, corps pur composé) de la substance.
$$\begin{array}{|l|l|}\hline\text{Substance}&\text{Nature de la substance}\\ \hline\text{Eau salée}&\text{mélange}\\ \hline\text{Jus de bissap}&\text{mélange}\\ \hline\text{Pain}&\text{mélange}\\ \hline\text{Dioxyde de carbone}&\text{corps pur composé}\\ \hline\text{Eau distillée}&\text{corps pur composé}\\ \hline\text{Dioxygène}&\text{corps pur simple}\\ \hline\end{array}$$
Exercice 16
Au cours d'une électrolyse de l'eau pure, un élève a recueilli $12.5\;cm^{3}$ d'un gaz qui rallume un brin incandescent.
1) Le gaz qui rallume un brin incandescent est caractéristique du dioxygène.
Il a été recueilli au niveau l'anode.
2) A l'autre électrode, plus précisément à la cathode, l'élève doit recueillir du dihydrogène.
Pour identifier ce gaz, on approche une flamme à la cathode, cela provoque alors une détonation. Ce qui montre la présence du dihydrogène.
Précisons son volume.
Pour cette expérience, nous savons que le volume de dihydrogène est le double de celui de dioxygène. Ainsi,
$$\boxed{V_{_{H_{2}}}=2V_{_{O_{2}}}}$$
avec, $V_{_{O_{2}}}=12.5\;cm^{3}$
Par suite, $V_{_{H_{2}}}=2\times 12.5=25$
D'où, $\boxed{V_{_{H_{2}}}=25\;cm^{3}}$
Exercice 17
Dans un eudiomètre, on mélange $40\;cm^{3}$ de dioxygène et $40\;cm^{3}$ de dihydrogène.
On fait jaillir une étincelle électrique dans le mélange.
1) Montrons qu'il reste un gaz à la fin de l'opération.
Lorsqu'on fait jaillir une étincelle électrique dans le mélange, on va observer simultanément l'apparition d'une flamme sous l'effet du dioxygène suivie d'une détonation provoquée par la présence du dihydrogène.
La réaction qui s'est produite a utilisé des volumes de dioxygène $V_{_{O_{2}}}$ et de dihydrogène $V_{_{H_{2}}}$ tels que :
$$V_{_{H_{2}}}=2V_{_{O_{2}}}$$
Ainsi, pour faire réagir tout le dioxygène, on aura aussi besoin d'un volume de dihydrogène $V_{_{H_{2}}}$ tel que :
$\begin{array}{rcl} V_{_{H_{2}}}&=&2V_{_{O_{2}}}\\&=&2\times 40\;cm^{3}\\&=&80\;cm^{3}\end{array}$
Or, on ne dispose que de $40\;cm^{3}$ de dihydrogène, dans l'eudiomètre.
Donc, il n'y a pas assez de dihydrogène pour faire réagir en même temps tout le dioxygène du mélange.
Ce qui fait que tout le dioxygène ne va pas réagir.
Et par conséquent, il va encore rester du dioxygène dans l'eudiomètre, à la fin de l'opération.
2) Déterminons le volume du gaz restant.
D'après la question 1), le gaz restant est du dioxygène. Ce qui veut dire que tout le dihydrogène a réagi.
Par suite, le volume de dioxygène réagi $V_{_{O_{2}(\text{réagi})}}$ est tel que :
$$V_{_{H_{2}}}=2V_{_{O_{2}(\text{réagi})}}$$
D'où, $V_{_{O_{2}(\text{réagi})}}=\dfrac{V_{_{H_{2}}}}{2}=\dfrac{40\;cm^{3}}{2}=20\;cm^{3}$
Le volume de dioxygène restant $V_{_{O_{2}(\text{restant})}}$ sera donc donné par :
$$V_{_{O_{2}(\text{restant})}}=V_{_{O_{2}}}-V_{_{O_{2}(\text{réagi})}}$$
A.N : $V_{_{O_{2}(\text{restant})}}=40-20=20$
Ainsi, $\boxed{V_{_{O_{2}(\text{restant})}}=20\;cm^{3}}$
Exercice 18
Recopions et complétons les phrases ci-dessous
1) A la pression atmosphérique normale, la vaporisation et la liquéfaction de l'eau pure se produisent à la même température constante égale à $100^{\circ}C.$
2) La fusion et la solidification de l'eau pure se produisent à la température constante égale à $0^{\circ}C.$
3) Pour un corps pur, la température d'ébullition et la température de fusion sont des constantes physiques.
Exercice 19
Une chambre fermée a les dimensions suivantes :
Longueur $L=3.50\;m\ $ largeur $\ell=3.20\;m\ $ et hauteur $h=3.10\;m.$
1) Calculons le volume d'air contenu dans la salle.
Soit $V$ le volume de la salle.
Comme l'air remplit toute la salle alors, le volume d'air $V_{\text{air}}$ contenu dans cette salle sera égal au volume $V.$ On a :
$$V_{\text{air}}=V=L\times\ell\times h$$
A.N : $V_{\text{air}}=3.5\times 3.20\times 3.10=34.72$
D'où, $\boxed{V_{\text{air}}=34.72\;m^{3}}$
2) Déduisons-en les volumes de dioxygène et de diazote contenus dans la salle.
L'air contenu dans la salle étant constitué de 1/5 de dioxygène et 4/5 de diazote alors, on a :
$$V_{_{O_{2}}}=\dfrac{1}{5}V_{\text{air}}\quad\text{et}\quad V_{_{N_{2}}}=\dfrac{4}{5}V_{\text{air}}$$
A.N : $V_{_{O_{2}}}=\dfrac{1}{5}\times 32.72=6.944\quad$ et $\quad V_{_{N_{2}}}=\dfrac{4}{5}\times 32.72=27.776$
Ainsi, $\boxed{V_{_{O_{2}}}=6.944\;m^{3}}\quad$ et $\quad \boxed{V_{_{N_{2}}}=27.776\;m^{3}}$
Exercice 20
Lorsqu'on sort une bouteille d'eau du réfrigérateur, ses parois extérieures se recouvrent de gouttelettes d'eau (buée).
Expliquons la provenance de cette buée.
Dans le réfrigérateur, la température est très basse. Donc, une bouteille d'eau sortie instantanément de ce réfrigérateur conserve la même température.
Ainsi, la vapeur d'eau contenu dans l'air, au contact avec les parois extérieures de la bouteille, se refroidit puis se condense pour enfin donner ces gouttelettes d'eau (buée).
On dit aussi que la vapeur d'eau contenu dans l'air s'est liquéfiée, au contact des parois extérieures de la bouteille.
Exercice supplémentaire
Exploitation d'un document
L'eau douce est rare dans les contrées désertiques ; or certaines d'entre elles, comme les pays du golfe persique, ont à leur portée d'immenses quantités d'eau de mer.
Cette inépuisable réserve d'eau, hélas, est inutilisable telle quelle, en raison de la présence du sel qui la rend impropre à la consommation et à l'irrigation des terres agricoles.
Aussi a-t-on pensé obtenir de l'eau douce à partir de l'eau de mer.
Le dessalement de l'eau de mer peut être pratiqué dans les usines situées à proximité des rivages.
L'eau de mer d'abord est portée à ébullition, puis la vapeur obtenue est liquéfiée.
1) Donnons un titre à ce texte : Le dessalement de l'eau de mer
2) La technique utilisée pour rendre l'eau de mer propre à l'irrigation est la distillation.
3) Les passages du texte qui relatent les différentes étapes de cette technique sont :
"L'eau de mer d'abord est portée à ébullition, puis la vapeur obtenue est liquéfiée"
4) Après liquéfaction, on obtient un corps pur ; l'eau.
5) Les mesures que l'on doit effectuer pour vérifier la pureté du corps recueilli sont :
$-\ \ $ Température d'ébullition
$-\ \ $ Température de fusion
$-\ \ $ Masse volumique
Les résultats attendus sont :
$-\ \ $ Température d'ébullition $100^{\circ}C$
$-\ \ $ Température de fusion $0^{\circ}C$
$-\ \ $ Masse volumique $1000\;kg.m^{-3}$