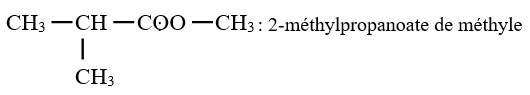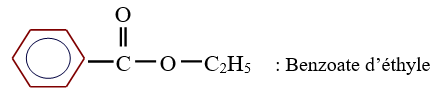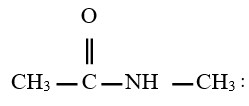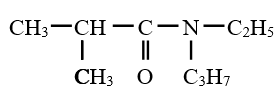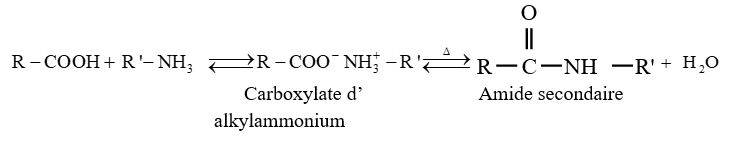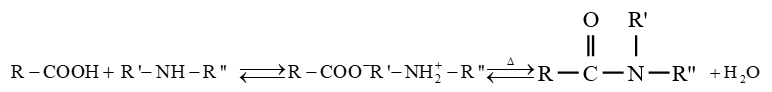pH d'une solution aqueuse-autoprotolyse de l'eau - produit ionique - indicateurs colorés - Ts
Classe:
Terminale
L'eau très répandue et apparemment très banale, du point de vue de la chimie est cependant, en permanence le siège des réactions chimiques entre ses molécules d'une part et les ions et les molécules des corps dissouts d'un autre part
I. Solutions aqueuses
De nombreuses espèces chimiques peuvent se dissoudre dans l'eau constituant ainsi des solutions aqueuses
1. Définition
Une solution aqueuse est un mélange homogène constitué d'un solvant (l'eau) et un ou plusieurs soluté(s)
2. Concentrations
2.1 Concentrations molaires
2.1.1 Concentration molaire volumique d'une solution
Si le soluté est un corps que l'on dissout dans le solvant la concentration molaire du soluté est définie :
$$C_{A}=\dfrac{n_{A}}{V}$$
$n_{A}$ en moles (mol)
$V$ en litres $(L)$
$C$ en moles par litres $(mol\cdot L^{-1})$
2.1.2 Concentration molaire volumique d'une espèce chimique en solution
La concentration molaire d'une espèce chimique $A$ en solution, notée $[A]$ est définie par le rapport :
$$[A]=\dfrac{n_{A}}{V}$$
$n_{A}$ en moles (mol)
$V$ en litres $(L)$
$[A]$ en moles par litres $(mol\cdot L^{-1})$
Exemple :
Exprimer les concentrations des ions d'une solution aqueuse de sulfate de sodium $Na_{2}SO_{4}$ de concentration $C$
Équation de dissolution :
$Na_{2}SO_{4}\stackrel{H_{2}O}{\longrightarrow}2Na^{+}+SO_{4}^{2-}$
$C$ $2C$ $C$
$\left[Na^{+}\right]=2C$ ; $\left[SO_{4}^{+}\right]=C$
2.2 Concentration massique
C'est la masse d'une substance $A$ dissoute dans un litre de solution
$$C_{m}(A)=\dfrac{m_{A}}{V}$$
$m_{A}$ en grammes $(g)$
$V$ en litres $(L)$
$C_{m}(A)$ en grammes par litres $(g\cdot L^{-1})$
Remarque :
Il existe une entre la concentration molaire et la concentration massique
$C_{m}(A)=C_{A}M_{A}$
II. Autoprotolyse de l'eau
1. Conductibilité électrique de l'eau
L'eau pure conduit légèrement le courant électrique.
Elle contient donc des ions
2. Ionisation partielle de l'eau : autoprotolyse de l'eau
La conductibilité électrique de l'eau pure est due à sa légère ionisation appelée réaction d'autoprotolyse
$H_{2}O\ +\ H_{2}O\ \leftrightarrows\ H_{3}O^{+}\ +\ OH^{-}$
ion hydronium ion hydroxyde
Dans l'eau pure, il y a donc un équilibre entre les ions hydronium et les ions hydroxyde et des molécules d'eau
L'eau pure a donc autant d'ions $H_{3}O^{+}$ et des ions $OH^{-}$
$\boxed{\left[H_{3}O^{+}\right]=\left[OH^{-}\right]}$
3. Le produit ionique de l'eau
La réaction de dissociation est une réaction d'équilibre.
Cet équilibre est caractérisé par une constante $Ke$ appelée produit ionique de l'eau
$\boxed{Ke=\left[H_{3}O^{+}\right]\left[OH^{-}\right]}$
$Ke$ augmente avec la température
$Ke=1.1\cdot 10^{-15}\text{ à }0^{\circ}C$
$Ke=10^{-14}\text{ à }25^{\circ}C$
$Ke=5.5\cdot 10^{-13}\text{ à }100^{\circ}C$
Remarque :
La constante $Ke$ du produit ionique de l'eau est valable non seulement pour l'eau pure, mais aussi toute pour solution aqueuse
II. $pH$ d'une solution
La connaissance de la teneur en ion hydronium seul ou en ion hydroxyde seul suffit pour savoir si une solution est acide
On convient de caractériser l'acidité, la basicité ou la neutralité d'une solution par la concentration en ion hydronium par une grandeur notée $pH$, grandeur liée à la concentration des ions hydroniums
1. Expression du $pH$ d'une solution
Le $pH$ d'une solution est un nombre par lequel on exprime la concentration des ions hydroniums d'une solution
$pH=-\log\left[H_{3}O^{+}\right]$ où $\left[H_{3}O^{+}\right]=10^{-pH}$
$\log$ représente le logarithme décimal
Remarque :
On peut aussi définir le $pOH$
$$\boxed{pOH=-\log\left[OH^{-}\right]}$$
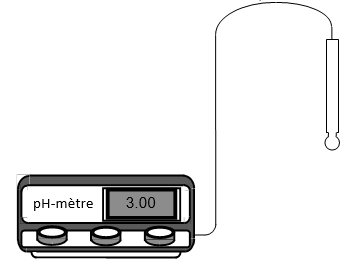
2. Mesure du $pH$ d'une solution
On mesure le $pH$ d'une solution à l'aide d'un appareil appelé $pH-$ mètre
Il est constitué de deux parties :
$-\ $ deux électrodes constituant une pile : une électrode indicatrice de $pH$, le plus souvent une électrode en verre ; l'autre électrode appelée électrode de référence, dont le potentiel est constant
$-\ $ un voltmètre électronique gradué en unités de $pH$ permet de mesurer la tension, fonction affine, entre les électrodes

Remarque :
Les deux électrodes peuvent être combinées ou non
3. Caractères acido-basique d'une solution
Si on dissout un composé ionique dans l'eau, ses ions peuvent réagir avec les ions de l'eau, mais le produit ionique de l'eau reste constant
$Ke=\left[H_{3}O^{+}\right]\left[OH^{-}\right]=10^{-14}\text {à }25^{\circ}C$
$\begin{array}{lcl} -\ \text{Si }\left[H_{3}O^{+}\right]>10^{-7}&\Rightarrow&-\log\left[H_{3}O^{+}\right]<-\log\,10^{-7}\\&\Rightarrow& pH<7\;,\text{ la solution est plus acide que l'eau} \end{array}$
$\begin{array}{lcl} -\ \text{Si }\left[H_{3}O^{+}\right]<10^{-7}&\Rightarrow&-\log\left[H_{3}O^{+}\right]>-\log\,10^{-7}\\&\Rightarrow& pH>7\;,\text{ la solution est plus basique que l'eau} \end{array}$
$\begin{array}{lcl} -\ \text{Si }\left[H_{3}O^{+}\right]=10^{-7}&\Rightarrow&-\log\left[H_{3}O^{+}\right]=-\log\,10^{-7}\\&\Rightarrow& pH=7\;,\text{ basicité ou l'acidité de la solution est la même que celle de l'eau} \end{array}$
La solution est dite neutre
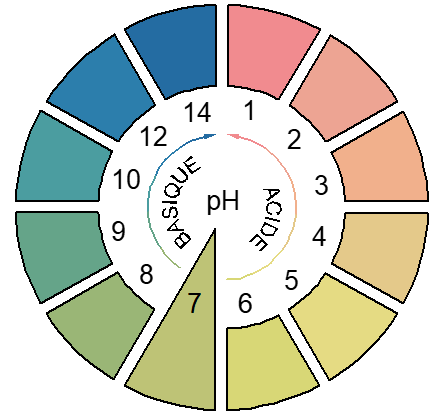
Échelle de $pH$ : Caractère d'une solution :
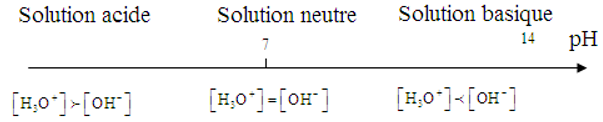
IV. Indicateurs colorés
1. Définition
Les indicateurs colorés sont des substances qui passent progressivement, quand le $pH$ croit, d'une couleur à une autre dans un petit domaine de $pH$ appelé zone de virage de cet indicateur
2. Exemples d'indicateurs colorés
$$\begin{array}{|c|c|c|c|} \hline \text{Indicateur}&\text{Teinte acide}&\text{Zone de virage}&\text{Teinte basique}\\ \hline \text{Hélianthine}&\text{Rouge}&2.4-4.4&\text{jaune}\\ & &\text{Orange}&\\ \hline \text{Phénolphtaléine}&\text{Incolore}&8.2-9.8&\text{Violette}\\ & &\text{Rose}&\\ \hline \text{Bleu de Bromothymol}&\text{Jaune}&6.0-7.6&\text{Bleue}\\ (BBT)& &\text{Verte}&\\ \hline \end{array}$$
3. Utilisation des indicateurs
L'utilisation des indicateurs colorés permet de déterminer une valeur approchée du $pH$ d'une solution.
On ajoute quelques gouttes de l'indicateur coloré dans la solution à étudier et on note la couleur obtenue
On peut aussi utiliser un papier $pH$
Il s'agit du papier préparé à l'aide d'un mélange d'indicateurs colorés et qui prend une couleur bien déterminée lorsqu'il est en contact avec une solution de $pH$ étudiée
Il suffit donc de mettre ce papier en contact avec la solution et de comparer la teinte qu'il prend avec une des teintes donnant le $pH$

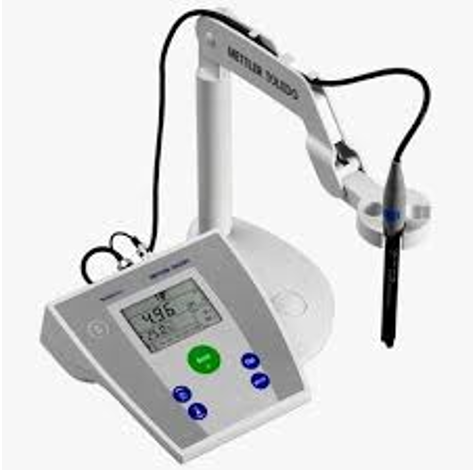
Un $pH-$ mètre
Le $pH-$ mètre est constitué d'une sonde relié à un voltmètre.
La sonde se compose d'une électrode de fer est d'une électrode de référence.
La tension $U$ aux bornes de la sonde plongée dans une solution est une fonction affine du $pH$ : $U= a-b\cdot pH$
Avant toute mesure, il est nécessaire d'étalonner un $pH-$ mètre avec deux solutions étalons de $pH$ connu $($généralement $4$ et $7).$
Cet étalonnage permet de fixer avec précision les valeurs de $'a'$ et $'b'.$
Un $pH$ mètre est précis à $0.05$ unité $pH$ environ.
L'incertitude relative sur la valeur de la concentration en ion oxonium est donc de $10\%$ environ.

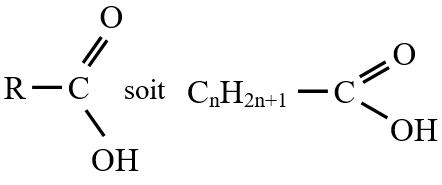
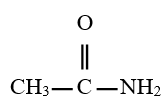
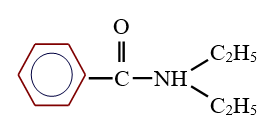
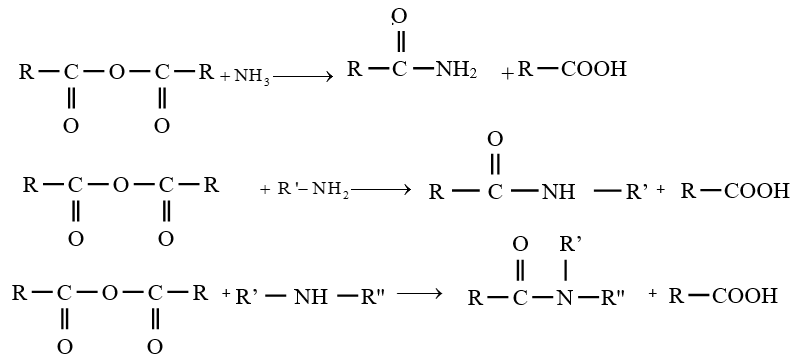
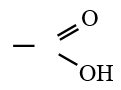 est le groupe fonctionnel appelé groupe carboxylique
est le groupe fonctionnel appelé groupe carboxylique

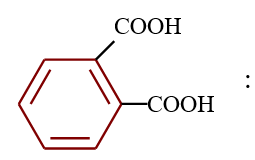
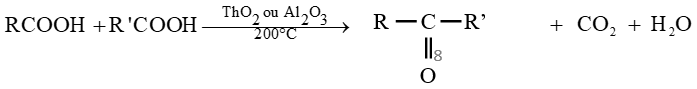
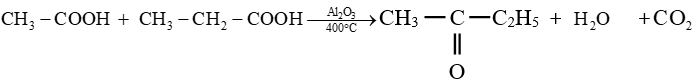
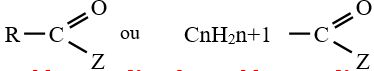
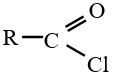
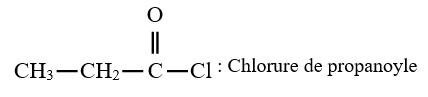
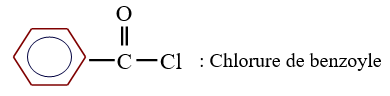

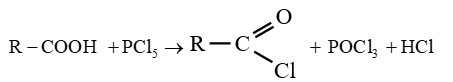
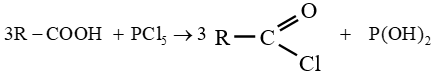
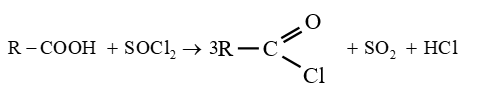
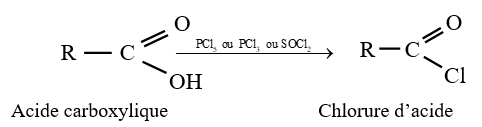
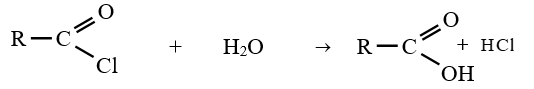
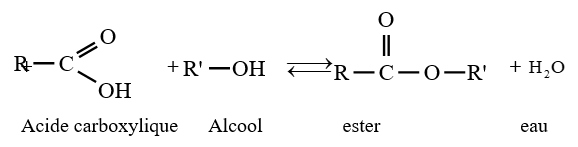
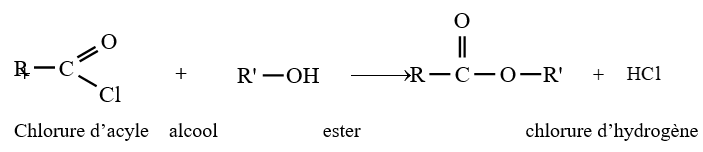
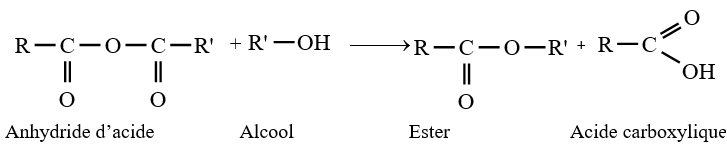
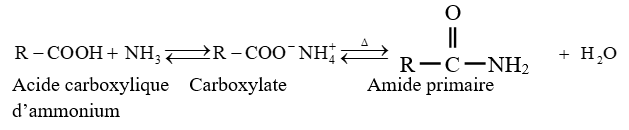
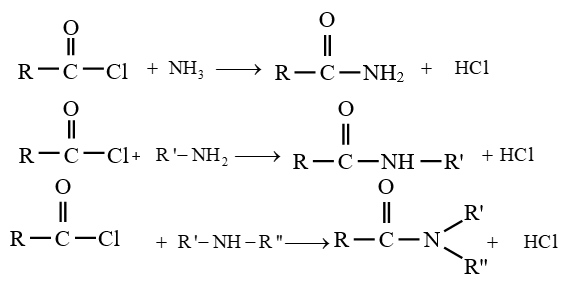
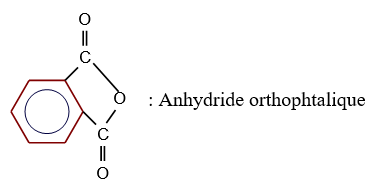
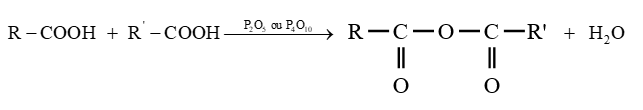
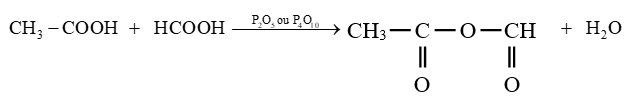
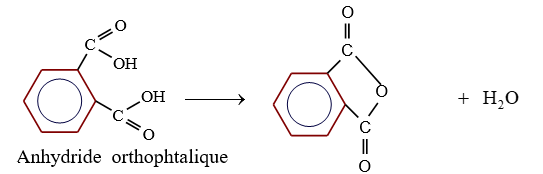
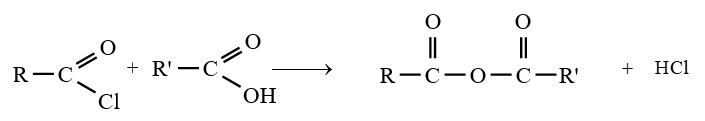
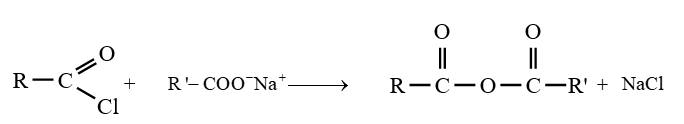
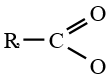 le dérivé d'acide carboxylique est un anhydride d'acide de formule générale :
le dérivé d'acide carboxylique est un anhydride d'acide de formule générale : 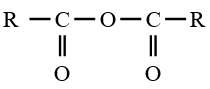 $\left(C_{n}H_{2n-3}O_{3}\quad n\geq 2\right)$
$\left(C_{n}H_{2n-3}O_{3}\quad n\geq 2\right)$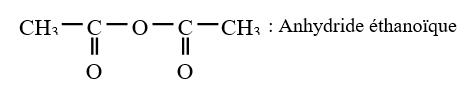
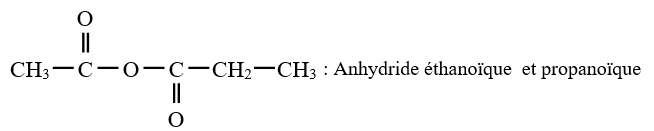
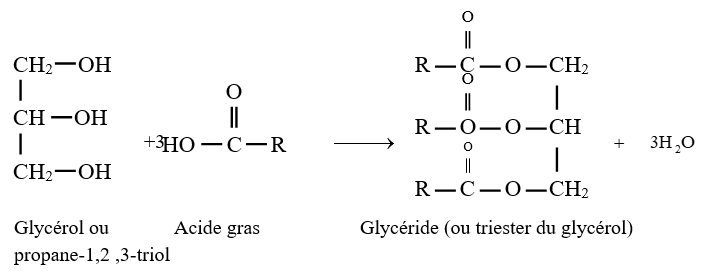
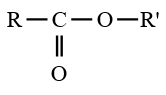 $\left(C_{n}H_{2n}O_{2}\text{ avec }n\geq 2\right)$
$\left(C_{n}H_{2n}O_{2}\text{ avec }n\geq 2\right)$